Comencemos sin más dilación con el silicio, conocido por todos los que hemos estudiado algo de electrónica como el elemento semiconductor por excelencia. Intentaré explicar un poco eso y quién sabe, quizás aprendamos todos un poquito más sobre este interesante metaloide.
Es el número 14 de la Tabla Periódica, con lo que podemos
afirmar tajantemente que tiene 14 protones (de no ser así, no sería silicio).
Además consta de 14 electrones (2,8,4) y entre 11 y 19 neutrones (14 de ellos en un 92´23% de los casos).
El hecho de que tenga 4 electrones en la última capa hace que
sea un elemento muy versátil. Con la misma facilidad con la que podría conseguir
4 más en dicha capa también podría perderlos. Recuerda que cuando hablé del
carbono dije algo parecido… el carbono podía formar enlaces con muchos otros
elementos, y el silicio no se queda atrás.
Además, es que es muy abundante. En peso, representa un 27% de
la corteza terrestre. Hay silicio everywhere, casi siempre en forma de sílice
(SiO2), que compone la mayoría de los minerales de silicio. Si está en forma
cristalina, formará cuarzo, el segundo mineral más común en la corteza
terrestre. La amatista es un tipo de cuarzo y también lo es el mineral de
ágata. Minerales como el sílex (pedernal. En latín "Piedra dura", que da nombre al silicio), el ópalo, el jaspe o la mica también están
formados por sílice, pero en este caso no de manera cristalina sino amorfa.
Si
el cuarzo era el segundo mineral más común, los feldespatos son más abundantes todavía,
suponiendo un, agárrate, 60% de la corteza terrestre. Están compuestos principalmente por silicio y oxígeno (además de potasio, sodio o calcio). Puedes
ver silicio en la playa, puesto que la arena es principalmente silicio y eso se
debe a que los minerales más abundantes de la corteza terrestre están formados
por silicio. El granito, una piedra muy común, está formado por cuarzo,
feldespato y mica. También la arcilla está formada por silicio. Como digo:
Everywhere.
 |
| Cuarzo. |
 |
| Jöns Jacob Berzelius. |
Lo que pasa con elementos tan promiscuos como el silicio
(independientemente de lo comunes que sean) es que al estar mezclados con otros
elementos, no se aislaron hasta hace un par de siglos. En la antigüedad se
usaban alguna de sus variadas combinaciones, pero no se sabía exactamente qué
había allí. Antoine Lavoisier supo, a finales del siglo XVIII, que había una
sustancia que formaba parte de la sílice pero no tenía entonces los medios para
profundizar más en el tema. No fue hasta 1823 que alguien pudo aislarlo e
identificarlo, en este caso fue Jöns Jacob Berzelius.
Al silicio puro no se le encontró ninguna utilidad práctica en esa época. Pero hoy en día es imprescindible en nuestra sociedad. Los chips electrónicos están hechos de silicio y sin chips electrónicos, hoy en día, no somos nadie. A parte, la arena y la arcilla son elementos fundamentales del hormigón y los ladrillos por lo que sin silicio, también nos quedaríamos sin casa.
La diferencia con el carbono es que los electrones del silicio están más sueltos, lo que le da el carácter metálico.
| Silicio. |
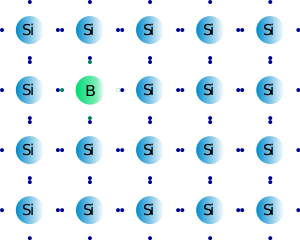
Para el tema de la electrónica, se le dice semiconductor. ¿Por qué? Porque se puede mezclar con otros elementos para cambiar sus propiedades
físicas. ¿Y cómo es esto? Bueno, el silicio cristalino forma unos enlaces
ordenados en los que un átomo de silicio se une a otros 4 átomos de silicio. No quedan, con esa estructura, electrones libres… pero si dopamos la estructura, y de vez en cuando
sustituimos un átomo de silicio por otro con 3 (aluminio, boro, galio) ó 5 (fósforo, arsénico, antimonio) electrones en la última
capa, entonces en esa estructura ordenada habrá sitios donde falte o sobre un electrón. Si el electrón del lugar que sobra pasa a donde falta… ¡voilá!
El caso es que, en electrónica, mezclando trocitos de silicio con impurezas de boro (Tipo P) y otro con impurezas de fósforo (Tipo N), podemos controlar la dirección de la corriente. Un transmisor típico tiene una estructura NPN, y funcionan como puertecitas que dejan pasar (o no) la corriente, lo que en electrónica digital se traduce como "1" ó "0". Sumando miles y miles de transmisores, podemos fabricar ordenadores con miles de "1" y "0". Y todo gracias al silicio. Y a sus dopantes, claro. Con los semiconductores, por cierto, también se fabrican por ejemplo los LEDs o los paneles solares foto-voltaicos. Genial ¿eh?.

El caso es que, en electrónica, mezclando trocitos de silicio con impurezas de boro (Tipo P) y otro con impurezas de fósforo (Tipo N), podemos controlar la dirección de la corriente. Un transmisor típico tiene una estructura NPN, y funcionan como puertecitas que dejan pasar (o no) la corriente, lo que en electrónica digital se traduce como "1" ó "0". Sumando miles y miles de transmisores, podemos fabricar ordenadores con miles de "1" y "0". Y todo gracias al silicio. Y a sus dopantes, claro. Con los semiconductores, por cierto, también se fabrican por ejemplo los LEDs o los paneles solares foto-voltaicos. Genial ¿eh?.


Para la electrónica, eso sí, el silicio tiene que ser puro. Hoy en día los transmisores son enanísimos y si el silicio es puro los electrones no tendrán ningún obstáculo. Si además los átomos de silicio están ordenaditos, lo que
facilita también la circulación de electrones, podremos hacer que el ordenador no falle. Si haces un
microchip y justo uno de los transmisores coincide con una impureza, es muy
posible que todo el chip no sirva para nada.
Se puede fabricar silicio a partir de sílice (SiO2) o, si lo que
queremos es pureza de la buena, a partir de triclorosilano (HSiCl3), un gas en
el que se introduce una barra de silicio y sobre la cual se irán depositando
los átomos de silicio obteniendo una especie de kebab brillante y muy puro.
Todavía se puede obtener un silicio más puro, en un proceso llamado proceso de
Czochralski, en el cual también se puede dopar los cristales de silicio. Se
trata de introducir un pequeño cristal de silicio en un recipiente con silicio
fundido. A ese recipiente se le pueden añadir otros elementos como boro o
fósforo para doparlo. Introducido el pequeño cristal en el recipiente, se irán
depositando los átomos de silicio sobre él obteniendo una barra de silicio
monocristalino, ideal para fabricar microchips. La barra que se obtiene se
corta en láminas muy finas que será donde se imprimirán los circuitos
electrónicos.
 |
| Lingotes y obleas de silicio puro. |
La microelectrónica y la construcción son los usos más importantes del silicio, pero existen más, claro. La fibra óptica se utiliza cada día más, por ejemplo. Está fabricada con sílice de alta pureza. Finísimos hilos de vidrio hecho con sílice.
Otro uso conocido es, por ejemplo, el del silicato de aluminio (Al2(SiO4)3), usado en forma de arena para tratamiento de superficies. Se chorrea a presión la arena de silicato de aluminio y una superficie, por ejemplo, la cubierta oxidada de un barco, se quedará bien lisita.
Antes ya he explicado que la arena está compuesta en buena medida por silicio. Muchas partículas pequeñas son pequeños cristalitos de cuarzo. No puedo dejar de mencionar la mejor arena del mundo, que está en una playa de Australia, The Whitehaven beach, que tuve la suerte de visitar hace unos años. Esa maravilla está compuesta, dicen, por un 98% de sílice. Dicen también que la NASA utilizó esa misma arena para pulir el espejo del Hubble, y que es codiciada por joyeros de todo el mundo para pulir sus piedras preciosas. Esa arena no se calienta al Sol y es de una finura y blancura que dan ganas de echarse a llorar. No he visto otra cosa igual.
 |
| Impresionante. |
Las siliconas, con toda su variedad de usos, también están compuestas de silicio. Son unos
compuestos formados por largas cadenas de átomos unidos gracias al silicio. ¿Te
acuerdas que el carbono también formaba largas filas?
El carbono, y esas largas filas, son esenciales para la vida en
la Tierra. ¿Podría haber vida basada en cadenas pero con silicio? En realidad,
tal y como la conocemos, no. Primero, las cadenas que forma el carbono, al ser
más pequeño, son mucho mayores. El agua es fundamental para la creación de la
vida porque transporta los elementos necesarios. Las células
tienen sus órganos en el agua, y no funcionarían si no fuera por ella. El tema
es que mientras que el dióxido de carbono se disuelve muy bien en el agua y es un gas, no
es así el dióxido de silicio, que es todo lo contrario.
El silicio, para la vida tal y como la conocemos, de hecho, no es muy bueno. En realidad, aunque sí que hay seres que lo utilizan, como los erizos de mar en sus espinas, las radiolarias (un tipo de protozoos) o las diatomeas (un alga que utiliza silicio para reforzar su pared celular), es el causante de una enfermedad llamada silicosis o neumoconiosis, que aparece por respirar demasiado polvo de sílice. Lo padecen los trabajadores del vídrio, por ejemplo, pero también las personas que viven cerca de un volcán, que también expulsan SiO2. Nuestros pulmones no diferencian el SiO2 del CO2 y acaban pagándolo caro. Dicen, como curiosidad, que pudo ser una de las causas de muerte de millones de dinosaurios cuando calló en la Tierra el meteorito que cambiaría el destino de nuestro planeta para siempre. Además, quizás hayas oído hablar del amianto, un tipo de minerales compuestos en buena medida por silicatos. En Europa está prohibido su uso desde hace años porque se demostró que es cancerígeno. Son conocidos los tejados de uralita, que todavía de vez en cuando puede encontrarse alguno, y que están fabricados con amianto y cemento. Tan bueno para unas cosas y tan malo para otras.
Siguiente elemento: El fósforo.
No hay comentarios:
Publicar un comentario